안녕하세요. 끄적이는 생명시간입니다:)
오늘은 지난번에 이어 이온크로마토그래피에 대해 포스팅하고자 합니다.
이온 크로마토그래피는 정제 공정 개발뿐 아니라 연구 중점의
실험실에서도 자주 사용되는 정제 방법입니다.
지난 시간에는 이온크로마토그래피 원리, 준비과정에 대해 알아보았다면,
이번 포스팅에서는 정제 방법 및 트러블 슈팅에 대해 알아보겠습니다.
*끄적이는 생명시간은 PC버전을 기준으로 작성되었습니다*
이온 크로마토그래피 정제 방법
본격적으로, 정제를 위한 프로토콜에 대해 다루어보고자 합니다.
일반적인 흐름은 다음과 같습니다.

1. Equilibration (평형화)
: 컬럼 및 기기의 pH, conductivity 등을 start buffer (또는 binding buffer)와 동일한 상태를 유지시켜 주기 위하여 컬럼 부피의 5-10배 용량이 흐를 수 있도록 진행
*컬럼 부피: CV, column volume. 자주 사용되는 약어이기 때문에 앞으로는 이 약어를 사용하도록 하겠습니다.
2. Sample application (시료 적용)
: equilibration buffer의 pH와 이온화 정도를 맞춘 시료를 컬럼에 적용합니다.
3. Equilibration wash (컬럼 세척)
: equilibration buffer를 이용하여 컬럼을 세척해 줍니다. 이 단계는 시료 적용 후 레진에 결합하지 않은 일부 불순물들이 컬럼 내에 잔류하여 용출/용리 단계에서 타깃 단백질과 함께 빠져나오지 않게 하기 위해 진행합니다.
4. Elution (용출/용리)
: 일부 매뉴얼에서는, 500 mM NaCl을 이용하여 50%까지 gradient elution을 주는 것을 추천하는 편이지만,
저는 일반적으로 1 M NaCl을 이용하여 0-100%로 gradient elution을 주어 진행하였습니다. gradient elution의 경우, 앞서 설명했던 것처럼 step elution에 비하여 시간이 많이 소요됩니다. 일반적으로 10-20CV로 elution step을 잡아줍니다.
5. Regeneration (재생)
: 레진과 강하게 결합하여 컬럼을 빠져나오지 못한 단백질 또는 불순물을 제거하기 위한 regeneration 단계를 진행합니다. 100% 1 M NaCl을 이용하여 5 CV정도 가해줍니다. 미처 제거되지 않는 불순물들은 CIP(cleaning in place) 단계를 사용하여 컬럼을 세척해 줄 수 있습니다. CIP는 컬럼에 따라 사용하는 용액이 다르지만 IEX의 경우, 0.3-0.5 M NaOH를 사용하여 세척해줍니다.
6. Re-equilibration (재평형화)
: 재생 과정을 거치면 컬럼은 고농도의 염 조건에 존재하거나 NaOH 상태로 존재하게 되는데 이 두 조건 모두 컬럼에는 harsh(해로운) 조건이기 때문에 해당 용액을 제거해 주는 것이 좋습니다. 따라서, 초반에 사용한 equilibration buffer를 사용하여 컬럼을 다시 세척해 줍니다. 이 과정은 보통 5-10 CV 정도 진행하며, 저 같은 경우에는 5 CV만 진행하는 편입니다.
Troubleshooting
크로마토그래피를 진행하면서 한 번에 실험이 완료되면 좋겠지만, 실험이라는 게 늘 예상대로 가는 것은 아니죠.
그래서 이온 크로마토그래피를 진행하면서 자주 생기는 문제에 대한 전략에 대해 설명하고자 합니다.
1. 단백질이 재생(regeneration) 단계에서 elution 되는 경우
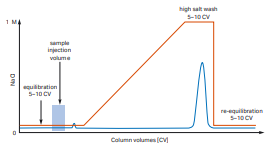
출처: cytiva
단백질과 레진 간의 결합이 매우 강할 때, 단백질이 gradient point에서 용출되지 않고 강한 elution 조건에서 레진과 해리되어 나오게 됩니다.
Anion exchange chromatography의 경우, 버퍼의 pH를 낮추고
Cation exchange chromatography의 경우, 버퍼의 pH를 높여
단백질의 pI에 가깝게 하여 레진과의 결합력을 감소시키는 방법으로 해결할 수 있습니다.
2. 단백질이 gradient elution 시작 전 elution되는 경우
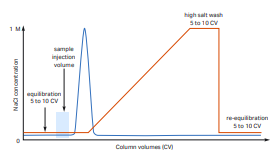
출처: cytiva
이 경우는, 위의 예시와 반대되는 상황입니다. 두 종류의 원인이 있을 수 있습니다.
하나는, 레진과 단백질 사이의 결합력이 약하여 레진에 결합하지 못하고 통과해 버리는 것입니다. 이런 상황에서는, 버퍼의 pH와 단백질의 pI 차이를 증가시켜 결합력을 높이는 방법을 사용합니다.
또 다른 하나는, 시료의 conductivity가 이미 높은 상태이기 때문에 결합할 수 없는 조건일 경우입니다. 이와 같은 경우, 시료를 equilibration buffer로 희석하는 배수를 높이거나 desalting(염 제거) 과정을 통해 시료의 conductivity를 낮추는 방법으로 문제를 해결할 수 있습니다.
3. 여전히 단백질이 gradient elution 시작 전 elution되는 경우
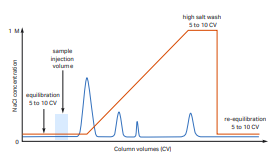
출처: cytiva
일부 단백질이 여전히 gradient elution전에 elution되는 경우, 여러 요인이 있을 수 있지만 대표적으로는 컬럼 내 불순물이 남아있거나 컬럼의 결합 용량을 초과한 경우에 발생합니다.
전자의 경우, 시료 적용 후 elution 전 equilibration buffer로 세척하는 단계의 부피를 증가시켜 남아있는 불순물이 없도록 하여 해결할 수 있습니다.
후자의 경우, 컬럼의 결합 용량에 맞추어 적용하는 시료의 양을 줄이거나 사용하는 컬럼의 부피를 늘려 사용하는 방법으로 해결할 수 있습니다.
4. Peak tailing
크로마토그램의 peak이 대칭적으로 나타나지 않고 뒤쪽이 끌리는 tailing 현상이 나타난다면,
equilibration 조건이 단백질에 적합하지 않아 시료가 컬럼에 결합하지 않을 수 있습니다. 이러한 경우는 버퍼의 pH 조건을 변경하고, 염 농도를 확인하여 타깃 단백질의 시료에 맞게 조정하여 해결합니다.
또는 시료의 점성이 높아 생길 수 있는데, equilibration buffer로 희석배수를 늘려 해결 가능합니다.
또 다른 요인으로는 컬럼의 패킹이 부적합하여 생길 가능성도 있습니다. 컬럼의 패킹 효율성 테스트를 통하여 컬럼을 확인하는 것이 좋습니다.
'생명공학 실험 끄적이기' 카테고리의 다른 글
| [생명공학 실험] 크기 배제 크로마토그래피 (Size-exclusion Chromatography, SEC)란? (원리 및 이용) (0) | 2023.07.26 |
|---|---|
| [생명공학 실험] CIPP에서의 이온크로마토그래피 (0) | 2023.07.25 |
| [생명공학 실험] 이온 크로마토그래피를 이용한 정제를 위한 준비 (레진 선택, 버퍼 준비, 시료 준비) (0) | 2023.07.03 |
| [생명공학 실험] Protein A와 Protein G 크로마토그래피의 차이 및 실험 주의사항 (0) | 2023.06.29 |
| [생명공학 실험] 항체 정제의 기본, Protein A/G 크로마토그래피 (0) | 2023.06.29 |


