안녕하세요. 끄적이는 생명시간입니다:)
오늘은 지난번에 이어 이온크로마토그래피에 대해 포스팅하고자 합니다.
이온 크로마토그래피는 정제 공정 개발뿐 아니라 연구 중점의
실험실에서도 자주 사용되는 정제 방법입니다.
지난 시간에는 이온크로마토그래피 원리를 알아보았다면,
앞으로의 포스팅에서는 정제 준비, 방법, 트러블 슈팅에 대해 알아보겠습니다.
*끄적이는 생명시간은 PC버전을 기준으로 작성되었습니다*
이온 크로마토그래피 정제
1. Anion exchanger vs Cation exchanger
이온 크로마토그래피를 이용하기 위해서는 어떤 종류의 exchanger를 사용할지가 중요합니다. 지난번의 포스팅에서 설명하였듯이, 단백질이 음전하일 때는 양전하인 anion exchanger를, 단백질이 양전하일 때는 음전하인 cation exchanger를 사용합니다.
그렇다면, anion exchanger와 cation exchanger 중 어떤 것이 더 좋은 크로마토그래피 방법일까요?
정답은 없습니다. 어떤 종류의 이온 크로마토그래피가 더 우수하다고 말할 수는 없습니다. 단백질의 특성에 따라 단백질의 안정성을 유지시켜 줄 수 있는 pH 범위 내에서 버퍼를 선택하고 그에 따른 exchanger를 선택하면 됩니다. 단백질이 안정한 pH 범위가 넓을 경우, 두 가지 종류의 exchanger를 모두 시도해 보고 분리능(resolution)이 더 좋은 exchanger를 사용하시면 됩니다.
다만, 주의할 점은, 버퍼의 pH는 단백질의 pI보다 0.5-1.0 정도 차이가 나도록 설정해야 합니다.
단백질의 pH가 등전점에 가까울수록 이온화가 덜 되기 때문에 exchanger와 이온화 결합을 할 수 없게 됩니다. 따라서 버퍼의 pH는 단백질의 이온화를 활성화 시킬 수 있도록 등전점과 차이가 나야 합니다. 하지만 이러한 차이가 극도로 심할 경우, 이온 상호 결합의 강도가 높아 단백질 정제 시 단백질과 레진의 결합이 해리되지 않을 가능성이 높아 적절한 차이로 값을 설정해야 합니다.
아래의 그림을 예로 설명해 보겠습니다.

Q. A라는 단백질의 pI값은 약 pH 5.2이며, A가 안정한 pH의 범위는 5.6-7.8일 경우, 선택해야 할 버퍼의 pH와 exchanger의 종류는 무엇일까요?
A. 버퍼의 pH는 단백질이 안정할 수 있는 범위 내에서 pI와 0.5-1.0 정도 차이가 나는 5.7-6.2를 사용해야 합니다. 이때의 A의 표면 전하는 음전하이기 때문에 anion exchanger를 사용하시면 됩니다.
2. Strong/Weak ion exchanger
이온 크로마토그래피의 exchanger의 종류에는 두 가지가 있고, 각 exchanger도 이온화 정도에 따라 여러 가지 종류가 존재합니다. 이온화 정도에 따라 strong/weak으로 분류됩니다. 여기서 언급한 이온화 정도는 exchanger에 단백질이 결합하는 강도를 의미하는 것이 아닌, pH에 따라 작용기의 이온화 상태가 변화하는 정도를 의미합니다.
초기 정제 시, 사용하고자 하는 pH의 범위가 넓을 때는 strong exchanger를 사용하여 정제 방법을 개발하고 단백질의 분리가 정상적으로 이루어지지 않을 때 weak exchanger를 시도해 보는 방법을 사용합니다.
일반적으로는 strong exchanger를 주로 사용하며, 각각의 종류는 아래 표와 같습니다.
|
Anion exchangers
|
Functional group
|
|
|
Quaternary ammonium (Q)
|
strong
|
-CH2-N+-(CH3)3
|
|
Diethylaminoethyl (DEAE)
|
weak
|
-CH2-CH2_N-(CH2-CH3)2
|
|
Cation exchangers
|
Functional group
|
|
| Sulfopropyl (SP) |
strong
|
(CH2)3SO3- |
| Carboxymethyl (CM) |
weak
|
OCH2COO-
|
3. 완충액 (Buffer) 선택
1) Buffer pH와 온도
- 버퍼는 산과 염기의 변화가 유지되는 용액으로, 버퍼의 종류마다 사용할 수 있는 pH의 범위가 달라집니다. 따라서 버퍼를 조제할 때, 이를 유의해서 만드는 것이 좋겠죠.
- 버퍼의 농도는 pH 유지의 목적이기 때문에 고농도보다는 20-50 mM의 낮은 농도를 사용합니다.
- 버퍼의 pH는 온도에 따라서 조금씩 달라지기도 합니다. 따라서 정제 전 사용하고자 하는 버퍼의 적합한 온도를 확인하는 것도 중요합니다.
- 단백질은 변성되거나 소수성 상호작용 (hydrophobic interacion)에 의하여 aggregation이 발생할 염려가 있기 때문에 10도 이하의 온도에서 버퍼를 선택하여 사용하는 것이 좋습니다.
2) Counterion (salt ion)
Counterion이란, 이온 크로마토그래피에서 exchanger와 결합한 단백질을 해리하는 데 사용되는 이온을 의미합니다. 염 이온이기도 하며 이온크로마토그래피를 위해 사용할 수 있는 counterion은 다음과 같습니다.

NaCl의 경우 chaotropic 성질을 가지고 있어 소수성 물질에서 낮은 'salting-out' 효과를 가지게 됩니다. 즉, 물의 극성을 줄이는 효과를 통해 단백질의 소수성 부분의 solubility가 증가하게 됩니다.
(쉽게 말해, 물은 극성을 띠기 때문에 소수성 분자는 물에 녹지 않죠. 하지만 물의 극성이 약해지게 되면 소수성 분자가 물에 녹는 정도가 증가하게 되어 solubility가 증가하게 되는 것이랍니다.)
4. 시료준비
이온 크로마토그래피는 염 농도를 증가시키면서 exchanger와 결합한 단백질의 solubility를 증가시켜 용출하는 방법입니다. 따라서 시료의 염 농도는 binding buffer와 유사한 수준을 가져야 합니다.
5. Elution (용출/용리)
이온 크로마토그래피를 이용한 단백질 elution은 elution buffer에 존재하는 anion 또는 cation들이 exchanger에 결합한 단백질들을 대체하여 결합하게 되면서 단백질이 레진과 해리되어 이루어집니다. 초기 정제 시, gradient elution 방법을 택하여 진행합니다.
① gradient elution
: 단백질이 어는 정도의 전도도에서 레진과 해리될지 알 수 없기 때문에 점진적으로 elution buffer의 농도를 높여 단백질이 elution 되는지점을 찾는 방법입니다.
> 각각의 단백질은 이온화 정도에 따라 레진과의 결합력이 다른데, 이를 이용한 용출 방법입니다. 이러한 이유로 초기 정제 방법을 찾기 위하여 사용합니다.
> 이온화 정도가 높아 레진과 결합을 강하게 할수록 낮은 농도의 염 조건에서는 용출되지 않고 높은 농도의 염을 처리해야 용출이 가능하기 때문에 이러한 레진과 단백질 간의 결합력 차이를 이용하여 물질을 분리하게 됩니다.

출처: cytiva
② step elution
: gradient elution으로 단백질이 elution되는 지점을 찾았다면, 이후 최적화 또는 개발 과정에서는 step elution으로 진행하여 정제를 진행합니다. step elution으로 진행하게 되면 천천히 점진적으로 염 농도를 올려야 하는 gradient elution과 다르게 단백질이 용출되는 염 농도를 바로 적용할 수 있기 때문에 정제 시간을 단축할 수 있다는 장점이 있습니다.
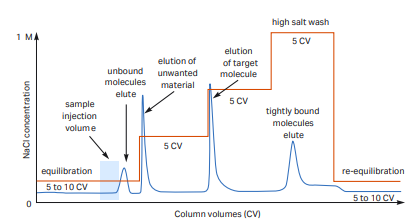
출처: cytiva
③ pH elution
: elution 방법에는 위의 두 가지 방법이 일반적이지만 이온 크로마토그래피의 경우 pH를 이용하여 elution을 진행하기도 합니다.
버퍼의 pH를 증가시키거나 감소시키는 방법으로 단백질의 용해도를 조절하여 용출하는 방법입니다. 버퍼의 pH가 단백질의 pI값에 가까울수록 단백질의 표전 전하를 0에 가까워지는 원리를 이용한 것이지요.
Anion exchanger를 사용하는 경우, pH를 감소시켜 가면서 단백질을 분리하고,
Cation exchanger를 사용하는 경우, pH를 증가시키면서 단백질을 분리합니다.
하지만, 버퍼의 pH가 단백질의 pI에 가까워질수록 단백질은 불안정해져 용해도는 최소화되고 그에 따라 침전(precipitation)이 발생할 수 있습니다. 이러한 경우에는 detergents나 denaturing agents와 같은 첨가물(additives)을 버퍼에 넣어 사용함으로써 완화시킬 수 있습니다.
6. 첨가제 (Additives)
첨가제는 정제 과정 중에서 단백질의 안정화에 도움을 주기 위해서 주로 사용됩니다. 또는 단백질의 dissociation(해리), solubilization(가용화), metal chelation(메탈 킬레이션), 효소 저해 등을 위해서 사용되기도 합니다. 첨가제는 버퍼에 넣어서 사용하거나 크로마토그래피 전의 시료에 첨가하여 사용되기도 합니다.
이온 크로마토그래피 첨가제 종류
|
종류
|
예시
|
상세 설명
|
|
Detergents
|
TritonX-100, sodium dodecyl sulfate(SDS), urea, polyoxyethylene sorbitans(Tween80)
|
- 단백질의 가용화제(solubilizing agents)로서 용해도가 낮은 단백질의 정제에 사용.
- 막단백질의 경우 소수성 부분이 많기 때문에 물에 대한 용해도가 낮음.
|
|
Denaturing agents
|
guanidine hydrochloride, sarcosy
|
- 단백질의 분리과정에서 시료의 초기 용해도를 향상시키기 위하여 사용.
주의) 단백질이 denaturation되기 때문에 꼭 필요한 사항이 아니라면 피하는 것이 좋음.
|
|
Zwitterionic additives(쌍극 이온)
|
CHAPS, CHAPSO
|
- gradient elution에 영향을 주지 않고 고농도의 elution 조적에서 단백질의 침전을 막기 위해서 사용.
|
|
Glycerol,
Monoethylene glycol etc.
|
- 버퍼에 첨가하여 사용.
- 단백질의 극성을 감소시키기 위하여 사용.
- 점성(viscosity)이 높기 때문에 40 % 이상의 농도로 상용하는 것은 지양해야 함.
> 점성이 높으면 컬럼에 가해지는 압력이 가해져 무리가 되고, 그에 따라 컬럼의 패킹이나 구성이 무너질 수 있음.
|
|
|
Metal Chelators
|
EDTA, EGTA
|
- EDTA와 EGTA는 카복실기를 포함하기 때문에, anion exchanger와 상호작용하여 레진과 결합.
> 컬럼에 결합할 수 있는 단백질의 용량이 줄어들고 그에 따라 약하게 결합한 단백질을 EDTA,EGTA가 대체하여 단백질의 용출/용리를 용이하게 함.
|
이온 크로마토그래피의 원리와 그와 관련하여 고려해야 할 사항들에 대해서 살펴보았습니다.
위의 내용을 간략하게 요약하자면, 이온 크로마토그래피 진행 전 준비해야 할 과정은 다음과 같습니다.
① 단백질의 pI 확인
② 단백질이 안정한 pH 범위 확인
③ 안정한 pH 범위 내에서 사용하고자 하는 버퍼의 pH 설정
④ Cation exchanger/Anion exchanger 선택
⑤ 시료 준비(binding buffer와 유사한 수준으로 평형화)
'생명공학 실험 끄적이기' 카테고리의 다른 글
| [생명공학 실험] CIPP에서의 이온크로마토그래피 (0) | 2023.07.25 |
|---|---|
| [생명공학 실험] 이온 크로마토그래피 정제 방법 (0) | 2023.07.25 |
| [생명공학 실험] Protein A와 Protein G 크로마토그래피의 차이 및 실험 주의사항 (0) | 2023.06.29 |
| [생명공학 실험] 항체 정제의 기본, Protein A/G 크로마토그래피 (0) | 2023.06.29 |
| [생명공학 실험] 친화성 크로마토그래피 (Affinity Chromatography)란? (0) | 2023.06.28 |


