안녕하세요. 끄적이는 생명시간입니다:)
오늘은 단백질 정제 실험인 크로마토그래피에 대해 알아보는 시간을 가져보도록 하겠습니다.
지난번에는 크로마토그래피의 원리와 이동상에 따른 크로마토그래피의 종류에 대해 알아보았습니다.
궁금하신 분들은 아래 링크를 확인해 주세요:)
[생명공학 실험] 단백질 정제의 기본! 크로마토그래피(Chromatography)란? 1편
오늘은 조금 더 자세히 나아가, AC, IEX, SEC 기본 내용에 대해 살펴보겠습니다.
*끄적이는 생명시간은 PC버전을 기준으로 작성되었습니다*
친화성 크로마토그래피, Affinity Chromatography
친화성 크로마토그래피는 단백질 정제에서 자주 사용되는 크로마토그래피예요. 레진이라고 하는 고정상과 단백질과의 결합력을 이용하여 단백질을 분리하는 실험 방법입니다. 단백질이 들어있는 혼합시료를 레진과 상호작용이 이루어질 수 있도록 하고 그 강도(결합력)의 차이에 의해 물질들을 분리할 수 있어요.
Affinity chromatography의 레진은 많은 종류가 있어요.
우선 레진에 대해 알아보겠습니다.
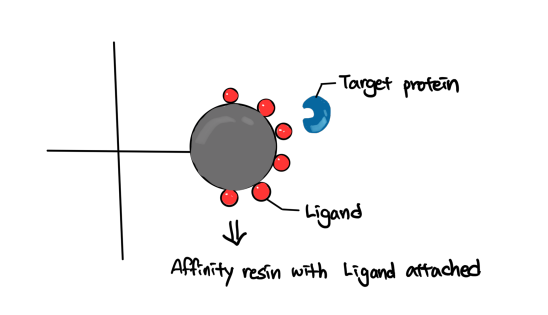
Affinity chromatography의 레진 도식화 그림
레진은 보통 이용하고자 하는 특징에 따라 ligand로 코팅된 형태를 띠고 있어요!
ligand 종류로는 Protein A, Protein G, Metal ions(Nickel, Cobalts), Glutathione 등 다양한 종류가 있어요! 타겟 물질이 무엇인가에 따라 선택해서 사용할 수 있어요!
Affinity chromatography는 특성에 따라 결합하는 능력을 이용하기 때문에 정제 시 물질의 손실이 적어 1차 정제 방법으로 많이 사용되고 있어요
"각 ligand 별 특징과 프로토콜 등 자세한 내용은 다음 끄적이는 시간에 다루도록 할게요!"
이온 교환 크로마토그래피, Ion-exchange chromatography, IEX
: Ion-exchange chromatography도 제약, 바이오에서 굉장히 많이 사용되는 크로마토그래피 방법이에요. IEX라고도 하며, IEX는 물질의 전하 차이를 이용한 이온 교환 매커니즘에 기반한 실험방법이에요!
IEX는 주로 전하를 띠는 양이온, 음이온, 아미노산, 펩타이드, 단백질 분리에 이용되는 실험 방법이에요
정지상(레진)의 전하와 반대 전하를 띠는 물질일수록 더 강하게 결합하여 더 늦게 용출되는 원리를 이용해서 단백질을 분리하게 됩니다.
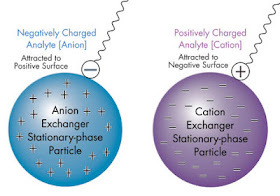
Cation and Anion exchanges stationary-phase
IEX는 음전하를 띠는 물질과의 결합/용출을 이용할 수 있는 Anion exchange chromatography(AIEX), 양전하를 띠는 물질과의 결합/용출을 이용할 수 있는 Cation exchange chromatography(CIEX)가 있습니다.
Anion exchanger는 레진이 양전하(positively charge,+)를 띠어 음전하를 띠는 물질과 결합하며,
Cation exchanger는 레진이 음전하(negatively charge,-)를 띠어 양전하를 띠는 물질과 결합하는 특징을 가지고 있어요!
이동상과 단백질의 pI(등전점)에 따라 CIEX와 AIEX를 적절히 사용하여 단백질 정제에 이용하게 됩니다.
Ion exchange chromatography도 affinity chromatography와 유사하게 특성에 따라 물질과의 결합력을 이용하기 때문에 1차 정제로 많이 사용하는 편이에요! 그리고 물질의 전하적 특징을 이용하기 때문에 타깃 단백질 외의 물질과의 분리에도 용이하여 2차, 3차 정제로도 이용되는 크로마토그래피입니다.
"이 부분에 대해서도 자세하게 다음 시간에 다루어 보도록 하겠습니다!"
크기 배제 크로마토그래피, Size-Exclusion Chromatography
: Size-exclusion chromatography는 물질의 크기에 따라 분리하는 크로마토그래피 기법입니다. Gel-filtration chromatography라고도 하며, 구멍이 뚫린 beads를 이용하여 물질이 beads 사이를 통과하는 속도의 차이에 따라 분리하게 됩니다.
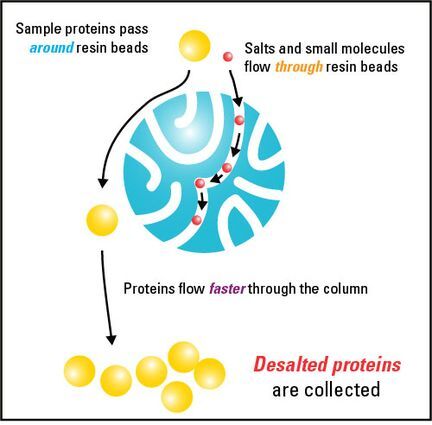
그림으로 보면, 더 이해가 빠를텐데요!
작은 크기의 물질일수록 beads의 구멍들을 지나가는 경로가 많아지고 그에 따라 칼럼을 빠져나오는 속도가 느려지게 됩니다.
그리고 크기가 큰 물질일수록 beads의 구멍들을 지나가는 경로가 짧아지고 그에 따라 컬럼을 빠르게 빠져나올 수 있겠죠!
Size-exclusion chromatography는 결합/용출 방법이 아니기 때문에 다른 크로마토그래피에 비하여 물질 분리능, 즉 해상도(resolution)가 낮은 편이에요. 따라서 정제 과정에서는 주로 초반에 사용합니다.
또한, 조건 테스트가 다른 크로마토그래피에 비하여 까다롭지 않기 때문에(화학적, 물리적 변화를 일으키지 않는) 단백질이 이동상에 의한 영향을 덜 받게 되고, 이러한 이유로 단백질의 구조 분석을 위해서 종종 사용되는 크로마토그래피예요!
이차원 크로마토그래피, Two-Dimensional Chromatography
: 일부 물질의 경우, 한 가지의 화학적 요법을 이용하여 분리하기 어려울 때가 있는데, 이때 이용하게 되는 크로마토그래피가 바로 이차원 크로마토그래피입니다.
이차원 크로마토그래피의 경우, 이용하는 경우가 많은 편은 아니지만 타깃 단백질과 불순물(Impurity)의 분리가 어려운 경우 사용할 수 있겠죠?
출처
1. Waters, Beginners Guide to Liquid Chromatography
3. My Scientific Blog - Research and Articles: ION EXCHANGE CHROMATOGRAPHY (upendrats.blogspot.com)
'생명공학 실험 끄적이기' 카테고리의 다른 글
| [생명공학 실험] 항체 정제의 기본, Protein A/G 크로마토그래피 (0) | 2023.06.29 |
|---|---|
| [생명공학 실험] 친화성 크로마토그래피 (Affinity Chromatography)란? (0) | 2023.06.28 |
| [생명공학 실험] 단백질 정제의 기본! 크로마토그래피(Chromatography)란? 1편 (0) | 2023.06.22 |
| [생명공학 실험] SDS-PAGE란 무엇인가? 2편 (시료 준비, 결과 분석) (0) | 2023.06.21 |
| [생명공학 실험] SDS-PAGE란 무엇인가? 1편 (목적, 원리) (0) | 2023.06.20 |



